
GMP 인증
 인증개요
인증개요
의료기기 국내.외 제조업자 및 임상실험용 의료기기를 제조하고자 하는 자에 대한 의료기기 GMP적합성 평가에 있어 평가 절차및 내용을 명확히 하여 투명성, 공정성을 확보하고자 함
 적용범위
적용범위
의료기기 제조, 수입 및 품질관리기준의 적용을 받는 범위는 다음과 같다.
1. 제조 또는 수입허가를 받거나 신고하고자 하는자.
▷ 품목허가(신고)전에 적합성 평가를 신청하여 인정받을수 있도록 함.
2. 임상시험용 의료기기를 제조하고자 하는 자
▷ 의료기기법 시행규칙 제13조제1항제10호에 규정
3. 적합성평가를 받고자 하는 의료기기 제조업자,수입업자.
▷ 품목허가후 판매 전에 적합인정을 받을수 있도록 함.
4. 품질관리심사 업무를 하고자 하는 자
▷ 품질관리심사기관이 준수해야 하는 세부사항 적용
 적합성평가
적합성평가
| 최초심사 | 제조업자 또는 수입업자가 해당 제조소에 대하여 처음으로 GMP적합성 평가를 받는 경우 |
| 정기갱신심사 | 고시에 의하여 3년마다 받는 검사 |
| 추가심사 | 새로운 품목군을 제조하는 경우 |
| 변경심사 | 소재지를 변경(이전)하는경우. 단, 제품의 품질에 미치는 영향이 적은 보관소 또는 시험실의 변경은 제외 |
 적합성평가 신청 제출서류
적합성평가 신청 제출서류
· 신청서
· 수입(제조)허가증 사본
· 제조소 개요
· 제조품질관련 종업원수
· 의료기기 목록(품목명, 등급)
· 생산국 품질경영시스템 적합인증서 사본
· 제조소 시설개요
· 소재지 및 업무범위
· 타기관 실사자료(해당하는 경우)
· 품질매뉴얼
· 제품표준서
· 설치 또는 사후지원이 필요한 제품은 관련 설명서
 공정밸리데이션
공정밸리데이션
밸리데이션(Validation) 이라함은 어느 특정한 공정, 방법, 기계설비 또는 시스템이 미리 설정되어있는 판정기준에 적합한 결과를 얻는다는 것을 검증하고 이를 문서화하는 것을 말한다.
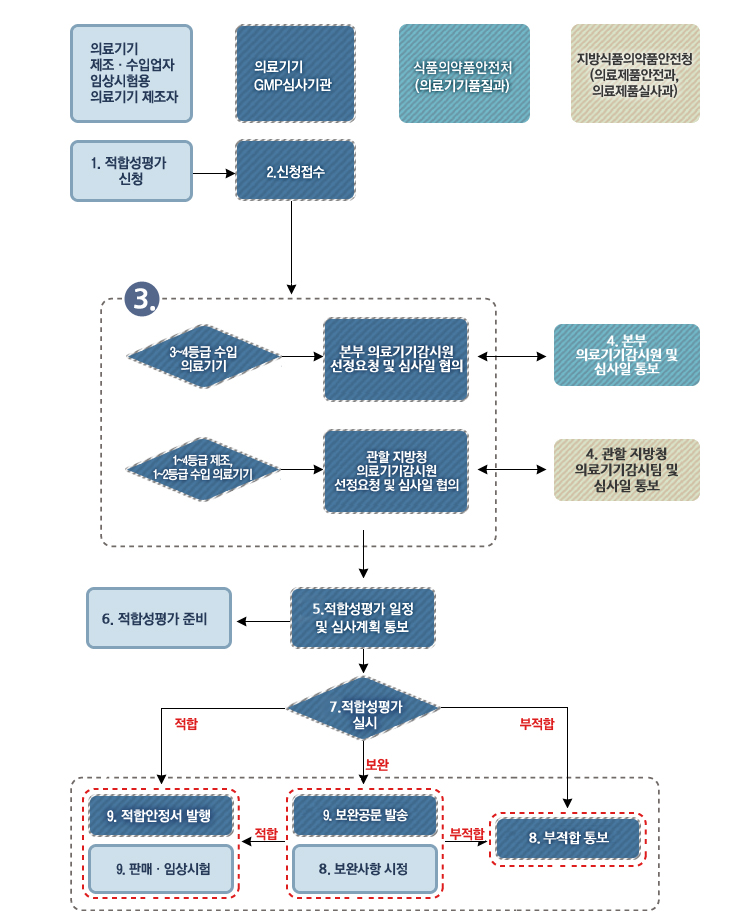
 인증 절차
인증 절차
ISO 13485
자세히 보기FDA
자세히 보기의료기기 CE marking
자세히 보기

